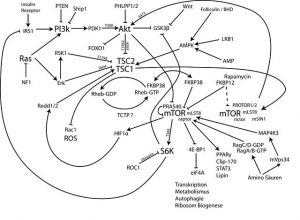
Der M-TOR-Signalweg und seine natürliche Hemmung oder Aktivierung
Der sogenannte mTOR-Pfad, oder auch mTOR-Signalweg, zählt zu einem der wichtigsten Forschungsgebiete der Molekularmedizin. Der Kurzname des 1994 entdeckten Eiweißkörpers mTOR steht für die englische Bezeichnung Mammalian Target Of Rapamycin – im sperrigen deutsch: “Ziel des Rapamycin bei Säugetieren”. Wie der Name nahelegt, ist seine Geschichte eng verknüpft mit der Erforschung des Wirkstoffs Rapamycin.
Energie und Wachstum bei aktivem mTOR
mTOR ist ein Eiweißstoff, der auf Informationen zum Energiestatus des Organismus reagiert und bei hoher Aktivität die Zellproliferation (= Zellwachstum und Vermehrung der Zellen durch Zellteilung) und Angiogenese (Entstehung neuer Blutgefäße aus vorbestehenden Blutgefäßen) fördert.
Oder weniger sperrig: Immer wenn man über viel Nahrung (hauptsächlich Eiweiß) und Energie verfügt, wird dem Körper signalisiert, dass er auf Wachstum und Volllast gehen kann. Zellen erhöhen die Teilung und machen sich bereit für Wachstum, Entwicklung und Reparatur. mTOR ist ein Enzym, das die maßgeblichen Befehle dazu erteilt.
Die Aktivierung des mTOR-Pfades kann leistungssteigernd, muskelaufbauend, wundheilend und wachstumsfördernd wirken. Nach einem harten Kraft-Training, ist die mTOR-Aktivität in der Skelettmuskulatur besonders hoch (nicht aber in allen Körperzellen). In Zeiten von Nahrungsknappheit wird der mTOR-Pfad gehemmt.
Während die Annahme naheliegt, dass Wachstum prinzipiell eine gute Sache sei, ist jedoch in manchen Konstellationen das Gegenteil der Fall, vor allem bei Erwachsenen. Denn ausgerechnet die Hemmung des mTOR-Signalwegs kann sich, wie die Wissenschaft der letzten Jahre immer deutlicher erforschen konnte, positiv auswirken. Hemmt man dieses Enzym, kann der reguläre Zellzyklus und damit die Teilung der Zelle (auch schädlicher Zellen!) nicht mehr ablaufen, es werden weniger Entzündungszellen gebildet, das Immunsystem wird in seiner Aktivität gebremst.
Der mTOR-Signalweg kann mit einem Kraftwerk verglichen werden. Man freut sich über eine hohe Energieproduktion, erzeugt dabei aber auch einiges an Dreck. Die Entfernung dieses Schmutzes wird im Körper u.a. durch einen Prozess bewerkstelligt, den man als Autophagie (engl. Autophagy) bezeichnet, und der ebenfalls zunehmend in den Blickpunkt der Forschung gerät. Autophagie tritt in der Regel dann in Erscheinung, wenn der mTOR-Signalweg gehemmt ist. Während hohe mTOR-Aktivität mit wenig Autophagie assoziiert wird, fördert geringe mTOR-Aktivität die Autophagie.
Wie bereits dargelegt, richtet die Forschung seit Längerem ihre Aufmerksamkeit auf die Hemmung der mTOR-Aktivität und deren mögliche nützliche Auswirkungen.
Denn die Folgen einer aus der Balance geratenen, übermäßigen mTOR-Aktivierung werden derzeit mit einer Reihe von Krankheiten in Verbindung gebracht, einschließlich Fettleibigkeit, Typ-2-Diabetes, Depressionen, Autismus, Alzheimer, Parkinson, bestimmte Krebsarten und zahlreiche andere Beeinträchtigungen. Im naheliegenden Umkehrschluss erhofft man sich durch die Hemmung des mTOR-Signalwegs die Bekämpfung vieler Beeinträchtigungen und die Verlängerung der Lebensspanne, einschließlich der Verjüngung von Geweben und des Immunsystems.1)”mTOR inhibition improves immune function in the elderly”, Science Translational Medicine, 24 Dec 2014: http://stm.sciencemag.org/content/6/268/268ra179?ijkey=9ff42770baeb95453468b60456b6ae16b14e90a1&keytype2=tf_ipsecsha.
Das Gute und das Schlechte im mTOR:
Nochmals sei darauf hingewiesen, dass der mTOR-Siganalweg auch mit wichtigen positiven Eigenschaften assoziiert ist. Die mTOR-Aktivierung ermöglicht es uns, mehr Muskeln und Fett zu bilden, die Wundheilung zu fördern, und verschiedene Hormone anzuregen, wie vor allem das leistungssteigernde und wachstumsfördernde IGF-1. MTOR ist an der Erzeugung neuer Mitochondrien beteiligt und steigert deren Stoffwechsel.
Aktiviert wird der mTOR-Signalweg u.a. durch die Hormone Testosteron, IGF-1, Insulin oder auch durch simples Krafttraining. Auch scheint die Aktivierung des mTOR-Signalwegs bestimmte Aspekte des Gedächtnisses zu fördern. Und auch hier zeigt sich die ambivalente Wirkungsweise des mTOR Enzyms. Da unser Gedächtnis auch negative Ereignisse, wie zB Traumata, speichert, wird von Wissenschaftlern neuerdings zur Behandlung von erworbenen Angststörungen diskutiert, ob es nicht zweckmäßig wäre, die m-TOR Aktivität medikamentös zu senken. Studien mit den m-TOR Hemmern Rapamycin und Curcumin liefern dazu erfreuliche Ansätze.2)https://www.sciencedirect.com/science/article/pii/S0166432813005445
Die Therapie für posttraumatische Belastungsstörungen (PTSD) ist jedoch nur ein vergleichsweise kleiner Aspekt, bei dem man es als vorteilhaft ansieht, die mTOR-Aktivität zu senken. In der jüngeren Vergangenheit wurden zahlreiche Medikamente entwickelt, die die mTOR Aktivität senken sollen, um dadurch auch schwerwiegende Erkrankungen zu behandeln:
Allen voran Rapamycin (Sirolimus) und dessen Derivative Everolimus, Temsirolimus, Ridoforulimus. Man zählt diese Wirkstoffe zu der ersten Generation der mTOR-Hemmer. Eine weitere Generation von mTOR-Inhibitoren soll nun auch effektiver einen zweiten Komplex der mTOR-Signalbildung, nämlich dem Complex 2 (MTORC2) beeinflussen.
Neben der medikamentösen Behandlung scheint es aber auch zahlreiche andere natürliche3)https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3775843/ Wege zu geben, die eine Hemmung von mTOR begünstigen können. Insbesondere bei der Beschränkung der Nahrungsaufnahme wurde eine geminderte mTor-Aktivität gemessen (und selbstredend auch ein erhöhte Autophagie).
Natürliche mTOR-Inhibitoren (Hemmer):
Ganz wichtig vorweg: Der Großteil der Forschung zu natürlichen mTor-Inhibitoren (Hemmung des mTor-Pfades) ist in einem sehr frühen Stadium. Zumeist handelt es sich um Studien in vitro – also im Reagenzglas. Nur wenige Substanzen sind auch in anderen Studien verfügbar und nur eine Substanz (DIM bzw. als Vorläufer Indol-3-Carbinol) wurde mit Menschen ausgiebiger getestet.
(Bei Klick auf die Fußnoten gelangen Sie zum Quellenverzeichnis der dazugehörigen Studien.)
Leider gibt es im deutschen Sprachraum nicht sehr viele verständliche Artikel zum Thema des mTOR Signalwegs, weswegen sich dieser Artikel um eine einfache Darstellung bemüht, die möglicherweise auch Punkte enthält, die dem komplexen Thema nicht gerecht werden, oder gar falsch sind. Seien Sie also kritisch beim Lesen dieses Beitrags. mTOR ist weder gut noch schlecht, sondern manchmal überaktiv, und manchmal unteraktiv und in hoffentlich den meisten Fällen gerade richtig ausbalanciert.
Medikamente, die den M-TOR Signalweg hemmen:
Zu den verbreitetsten Medikamenten, die den mTor-Signal Weg mindern zählen u.a.:
- Metformin
- Rapamycin (Sirolimus)
- Aspirin
Kein Wunder, dass sich diese Medikamente in der Anti-Aging-Szene größerer Aufmerksamkeit erfreuen. Das führt sogar soweit, dass mancherorts sehr kreative Methoden angewandt werden um zB an das Diabetes-Mittel Metformin heranzukommen.
Geschichte des Rapamycin
Die Widersprüchlichkeit der derzeitigen Forschungserkenntnisse zum mTOR Wirkmechanismus zeigt sich am anschaulichsten an dessen wichtigsten Inhibitor (Hemmer), dem Rapamycin (Sirolimus). Rapamycin ist ein bakterielles Produkt, das in Bodenproben enthalten war, die man 1965 auf der Suche nach antifungalen Substanzen auf der Osterinsel (indonesisch: Rapa Nui) entnommen hatte. Aus diesen Proben hatte 1972 ein Forscher ein kleines Molekül aus dem Bodenbakterium Streptomyces hygroscopicus identifiziert, und eine starke antimykotische Aktivität festgestellt. Bald stellte sich heraus, dass dieser Stoff auch immunsuppressive und zytostatische Eigenschaften aufwies. Dabei hatte man aber keine Vorstellung über die zugrundeliegende Wirkungsweise. Als man 1994 entdeckte, dass Rapamycin an einen bestimmten Eiweißkomplex in der Zelle andockte, blieb zunächst rätselhaft, was dieser Eiweißkomplex eigentlich sonst noch für eine Funktion hatte, außer, dass er als Andockstelle für das 30 Jahre zuvor entdeckte Rapamycin fungierte. Daher nannte man dieses Eiweiß-Enzym etwas einfallslos “mTOR“, mammalian Target Of Rapamycin (zu deutsch in etwa: Ziel des Rapamycin in Säugern). Später entdeckte man, dass Rapamycin die mTOR-Aktivität senkt. Im Lauf der Zeit stellte man immer häufiger fest, dass sich trotz der immunsuppressiven Wirkung von Rapamycin auch eine Wirkung gegen bestimmte Tumore und andere Krankheitsbilder nachweisen lies. Danach wurde es sogar als lebensverlängerndes Anti-Aging Mittel gehypt.20)https://derstandard.at/1246541692252/Anti-Aging-von-der-Osterinsel) Das scheint alles irgendwie nicht zusammenzupassen, immunsuppressiv und gleichzeitig bestimmte Tumore bekämpfend? Jedenfalls scheint heute klar zu sein, dass die Wirkungsweise des Rapamycins auf die Hemmung des mTOR-Signalwegs zurückzuführen ist und mTOR eine wesentliche Schlüsselstelle im Körper darstellt, ohne die die Energieverwertung und Regulierung der Energie gar nicht denkbar ist.
Und wie kam das Rapamycin überhaupt auf die Osterinsel?
Man weiß es nicht.
Rapamycin wurde eine Zeitlang als das Anti-Aging-Mittel schlechthin gehandelt. Es gibt zahlreiche erprobte Einsatzgebiete für das Rapamycin. Angesichts erfolgversprechender Resultate manch klinischer Studie, zum Teil auch bei sehr schwerwiegenden Erkrankungen, mag man sich die Frage stellen, warum seine therapeutischen Anwendungsgebiete nicht noch viel mehr erforscht werden. Die Antwort scheint leider banal. Rapamycin lässt sich nicht mehr patentieren. Daher haben Pharmaunternehmen kein Interesse, Geld in die Erforschung dieses Wirkstoffes zu investieren. Diese Feststellung trifft eines der renommiertesten Wissenschaftsmagazine Nature im Jahr 2014.21)https://www.nature.com/news/pet-dogs-set-to-test-anti-ageing-drug-1.16237
Sehr vieles dazu liegt also noch im Dunkel. mTOR wirkt in verschiedenen wichtigen Signalwegen (Complex 1 MTORC1 und Complex 2 MTORC2) und die Hemmung oder Aktivierung des jeweiligen Complexes bedingt wohl auch verschiedene Auswirkungen. Und was die Beeinflussung des zweiten Signalwegs (MTORC2) betrifft, steckt die Forschung überhaupt noch in den Kinderschuhen.
Quellenverzeichnis